Recherche

Le weekend du 15-16/09/2018 s'est tenue la conférence de l'EHDN (European Huntington Disease Network) à Vienne. La société pharmaceutique Roche a fait une annonce importante concernant la planification de la phase III du médicament RG6042 qui diminue la présence de huntingtine.
Début Août, L’Agence Européenne des Médicaments (EMA) a attribué la désignation de médicament prioritaire (PRIME) au traitement expérimental Roche RG6042.
Il reste maintenant à déterminer :
- Quels sont les effets liés à la réduction de la huntingtine mutante (mHTT), la protéine toxique qui provoquerait la maladie, sur une période de temps plus longue que l'étude de phase I/IIa de 13 semaines?
- Si le traitement prolongé par RG6042 ralentit ou arrête la progression de la MH?
- S’il existe des problèmes de sûreté lorsque le RG6042 est administré à un groupe plus important et pendant plus longtemps que les 46 personnes ayant participé à la phase I/IIa?
- Si une dose moins fréquente que la dose mensuelle utilisée dans l'étude de phase I/IIa pourrait être efficace?
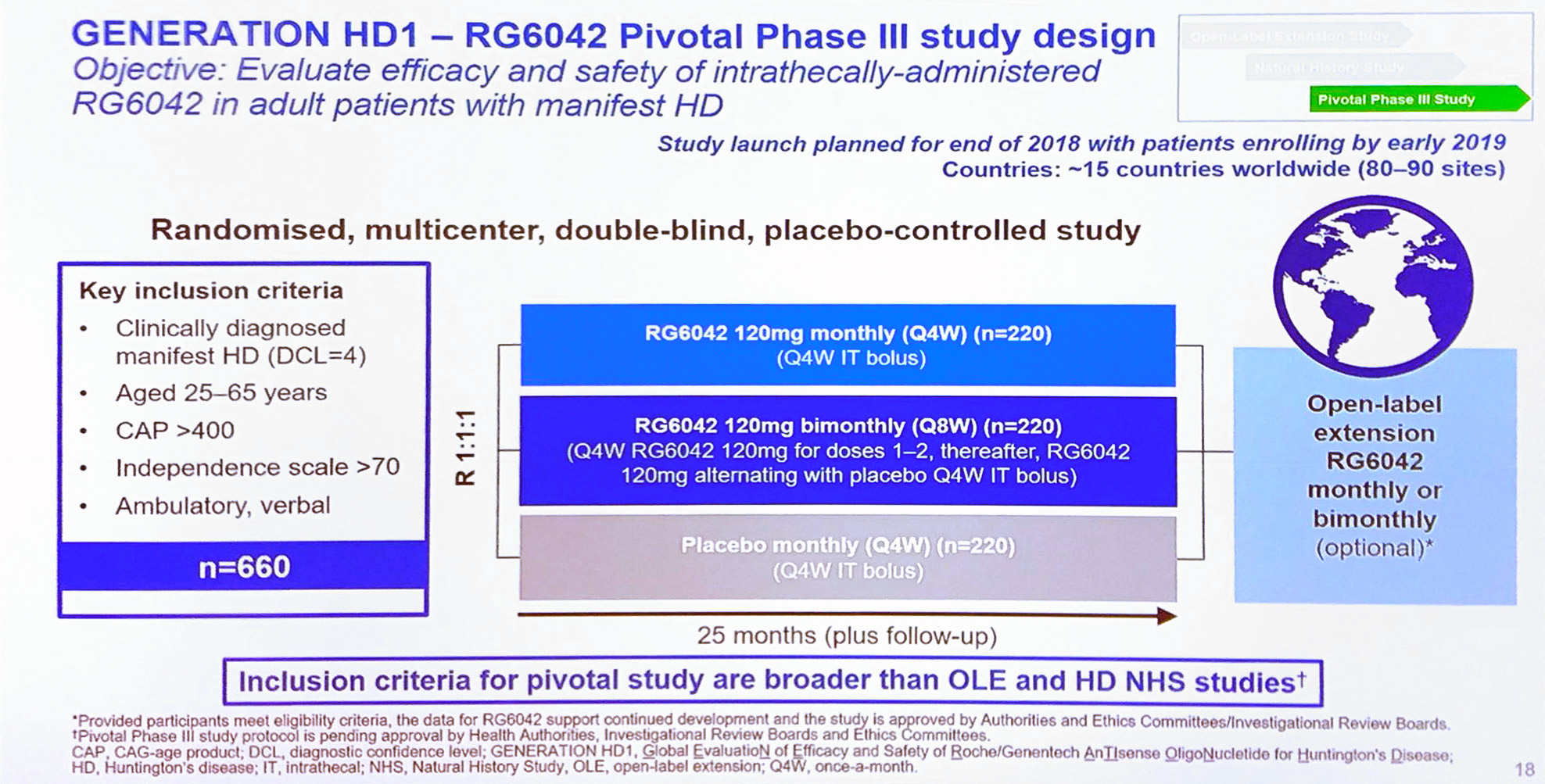
Roche va lancer fin 2018 l’étude clinique de phase III « GENERATION HD1 » pour évaluer l’efficacité et la sûreté du traitement RG6042 administré (mensuellement ou bimestriellement) sur une période de 2 ans.
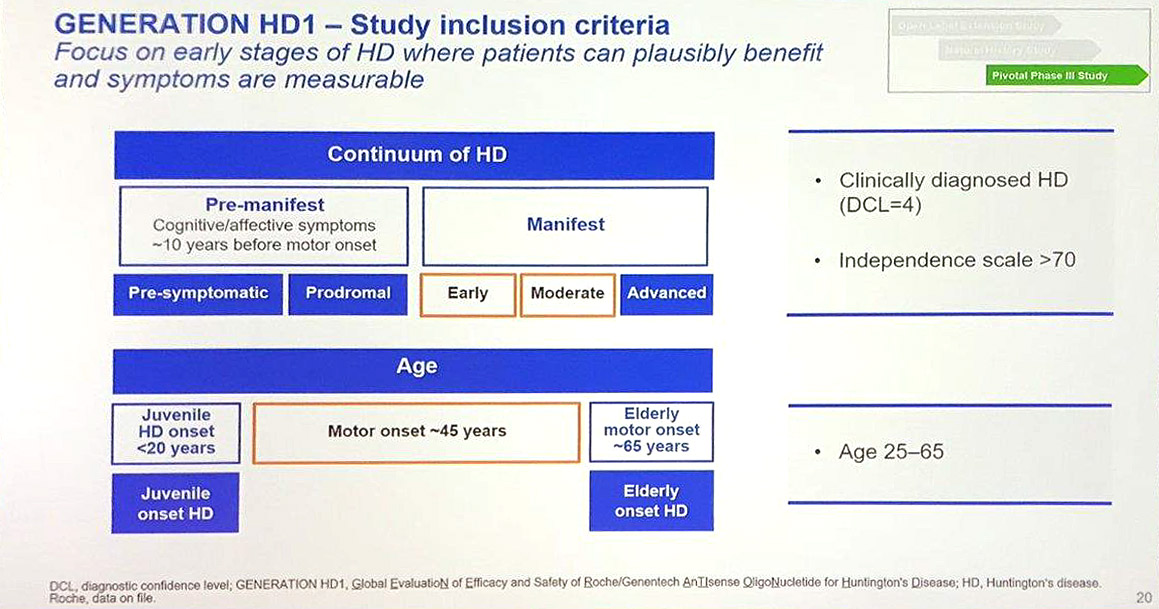
Cette étude mondiale permettra de recruter jusqu'à 660 patients (entre 25 et 65 ans avec des signes manifestes de la maladie) sur 80 à 90 sites dans 15 pays à travers le monde. Une fois qu'un site sera prêt à recruter des patients, Roche mettra à jour les informations sur le site Clinical Trial.
Le communiqué complet en anglais :
https://hdsa.org/wp-content/uploads/2018/09/Roche-global-HD-community-letter-Sept-2018.pdf
Clinical Trial (filtre sur les études cliniques de phase 3 pour la maladie de Huntington activé) : https://clinicaltrials.gov/ct2/results?cond=huntington&Search=Apply&recrs=b&recrs=a&recrs=f&recrs=d&recrs=m&age_v=&gndr=&type=Intr&rslt=&phase=2
Consultez les slides de présentation de Roche lors de l'EHDN 2018 de Vienne en cliquant ici
Le compte rendu sur HD Buzz : https://fr.hdbuzz.net/263
Ci-dessous les critères d'inclusions pour l'étude clinique :

Depuis l’identification du gène de la maladie de Huntington en 1993, des équipes de chercheurs, aux quatre coins du globe, explorent différentes voies thérapeutiques. Notre association est régulièrement informée des avancées scientifiques majeures dans le domaine de la maladie de Huntington.
Mr Albert Counet, notre vice-président, vous relate ci-dessous les informations importantes à ce sujet en date d’octobre 2014 :
« Afin d’éviter la duplication des efforts et la dispersion des moyens, la recherche est coordonnée au niveau mondial par une fondation philanthropique américaine privée, la Fondation High-Q.
Parmi les projets financés par High Q, on trouve le Cure Huntington Disease Initiative (CHDI), créé afin d’accélérer la transition de la recherche sur la MH du laboratoire vers la clinique. CHDI fonctionne comme une entreprise de biotechnologies virtuelle, à but non-lucratif, dédiée à la recherche et au développement de médicaments pour la MH. Cette initiative a déjà généré environ 130 projets avec un financement de plusieurs dizaines de millions de $.
High-Q sponsorise également le Réseau Européen EHDN « European Huntington Disease Network » créé en 2004 lorsqu’il est apparu souhaitable de créer une infrastructure indépendante des financements de l'industrie pharmaceutique pour effectuer ces recherches thérapeutiques.
European Huntington Disease Network a tenu son Congrès biennal du 18 au 21 septembre 2014 à Barcelone. Plus de 900 personnes (scientifiques, associations de familles, académiques, firmes pharmaceutiques et biotechnologiques) ont participé au Congrès. Le nombre, la variété et la qualité des participants témoignent de la solidarité constante du réseau et de l’intérêt grandissant des intervenants potentiels.
Des informations détaillées peuvent également être obtenues sur le site www.euro-hd.net ou sur le site www.HDBuzz.net la revue de EHDN en langage accessible pour tenir la communauté Huntington informée des progrès de la recherche.
Très important pour les familles est la confiance réaffirmée de la communauté scientifique que des solutions vont progressivement être disponibles pour retarder / ralentir / atténuer les effets de la MH. Pas moins de 5 essais cliniques de phases II et III vont être réalisés en 2015 sur plus de 1.000 personnes, dans différents pays et sur 4 continents. Pour rappel, la phase III est la dernière avant l’arrivée du médicament chez les malades. En 2015 va également commencer, sur des humains, la phase I d’une étude visant à éliminer les agrégats de huntingtine dans le cerveau. Des procédures ont été testées avec succès sur toute la chaine animale (d’abord sur des cellules de souris puis in vivo jusqu’aux primates). Enfin plus de 20 tests et recherches diverses impliquant des firmes de bio technologies et des laboratoires universitaires commenceront en 2015.
3 éléments particuliers méritent l’attention des familles :
- L’implication croissante des firmes pharmaceutiques,
- Le rôle fondamental d’ENROLL-HD,
- Pourquoi tout cela dure-t-il si longtemps ?
![]()
Implication croissante des firmes pharmaceutiques
On constate une implication croissante des grandes sociétés pharmaceutiques et biotechnologiques dans la recherche de solutions pour la maladie de Huntington. Cela est vraisemblablement dû à la conjonction de 2 éléments :
- Parmi les maladies neurologiques dégénératives la MH est la seule dont la cause est identifiée (le maudit gène !).
- La conviction que des solutions pour la MH bénéficieraient vraisemblablement à d’autres maladies neuro-dégénératives (augmentant ainsi le marché potentiel).
On doit certainement ajouter les rôles fondamentaux que les organisations CHDI et EHDN jouent dans ce contexte. Elles permettent en effet une coordination de la recherche au plan mondial, selon des procédures et des standards de qualité stricts. En travaillant dans la recherche Huntington, tous les partenaires savent qu’ils s’inscrivent dans des cadres très clairs, transparents et rigoureux.
La disposition d’un pool considérable de candidats potentiels à des essais que constituent ENROLL-HD et REGISTRY (bientôt fusionnés en un fichier unique de plus de 25.000 personnes) permet d’accélérer les procédures de recrutement pour des tests transnationaux.
Et enfin, les actions de sensibilisation menées de par le monde par les différentes Associations Huntington jouent un rôle non négligeable dans la motivation des chercheurs de tous bords.

Le rôle fondamental d’ENROLL-HD
ENROLL-HD est une étude globale multi centres de la Maladie de Huntington. Elle est ouverte à la participation de familles MH en Amérique du Nord, Europe, Amérique Latine, Australie / Nouvelle Zélande et certains pays d’Asie. Le but ultime d’ENROLL-HD est d’accélérer la découverte et le développement de nouvelles thérapies pour la MH.
ENROLL-HD est également une plateforme pour faciliter la recherche clinique sur la MH de par le monde. L’étude donne accès à des données cliniques et des bio-spécimens collectés auprès des participants (de 25 à 35.000 personnes sur 200 sites et sur les 4 continents). Il encourage l’utilisation de données pour informer au sujet d’essais cliniques futurs et de faciliter le recrutement pour les essais en accélérant l’identification de candidats potentiellement éligibles pour ces essais.
Pourquoi tout cela dure-t-il si longtemps?
La réponse est simple : parce qu’on ne peut prendre aucun risque avec la sécurité. Avant qu’un médicament arrive sur le marché, différentes étapes doivent être franchies :
D’abord il faut une idée et de la recherche fondamentale qui permet de déterminer si une piste mérite d’être explorée,
Puis commencent les phases précliniques (avant de passer aux essais sur des humains)
- Essais « in vitro » sur des modèles animaux,
- Essais « in vitro » sur des cellules humaines),
- Essais « in vivo » sur des animaux (d’abord des rongeurs, puis des petits mammifères, enfin sur des primates),
Enfin commencent les essais cliniques sur des humains,
- Phase I : pour s’assurer de la sécurité du médicament,
- Phase II : pour tester la pertinence du médicament (dosage et posologie),
- Phase III : généralisation sur un plus grand nombre de personnes pour s’assurer que tout fonctionne comme prévu.
Finalement, si toutes les étapes sont franchies, introduction d’une demande de mise sur le marché auprès des autorités régulatrices.
Chaque étape doit être organisée, exécutée, contrôlée puis évaluée selon des règles et procédures très strictes. Il s’agit de la santé et de la vie de personnes et aucun risque ne peut être pris. Par le passé, dans le cadre d’autres maladies, des procédures mal maîtrisées ont parfois conduit à des conséquences très graves.
Huntington étant une maladie rare, invalidante et à pronostic fatal, bénéficie cependant d’une procédure simplifiée permettant d’un peu accélérer le processus (par ex. un essai de Phase III peut se faire sur moins de patients que pour un médicament « grand public »). »